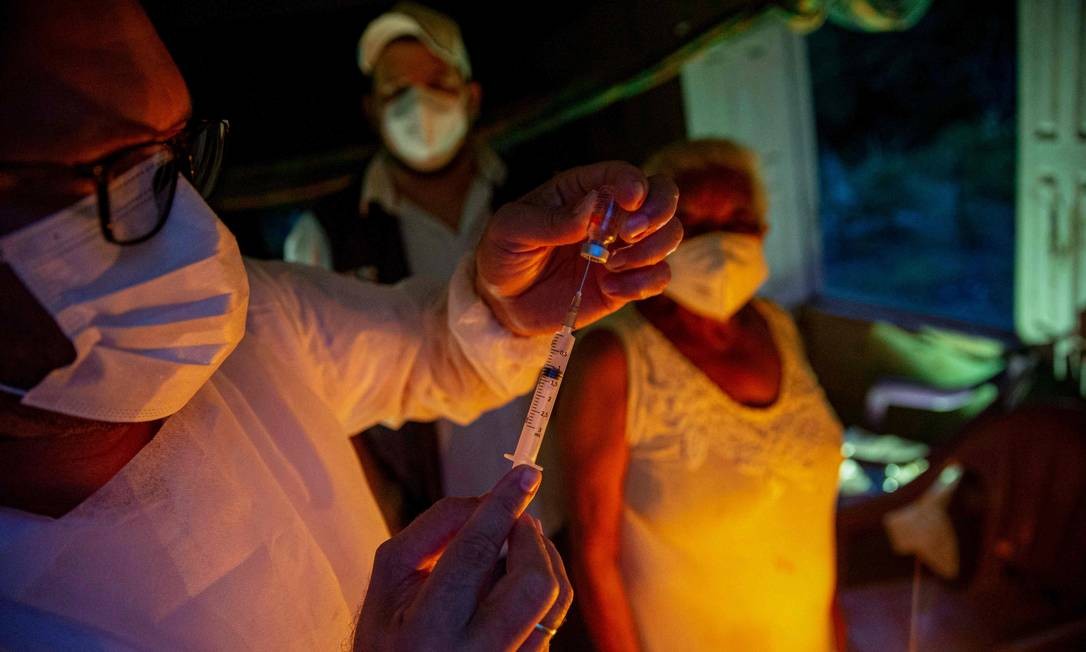
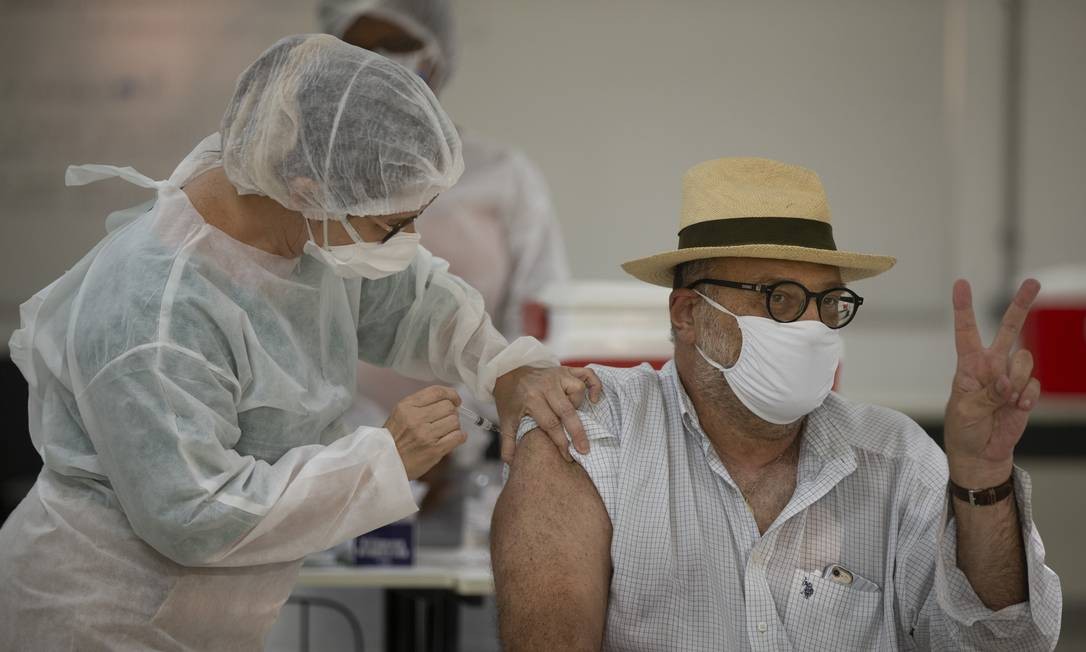
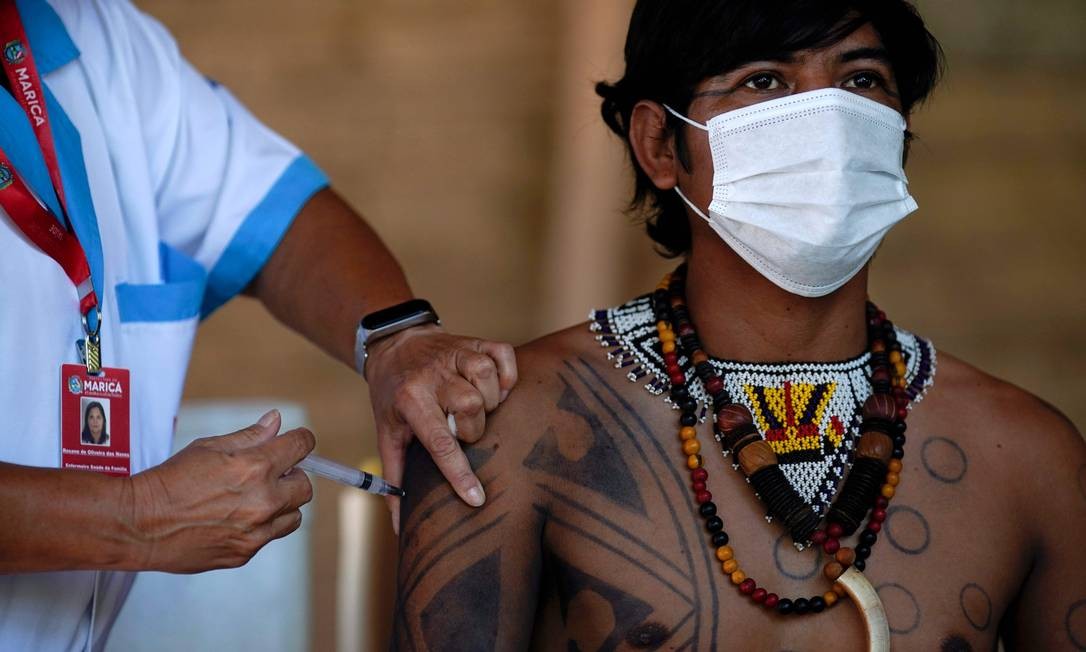
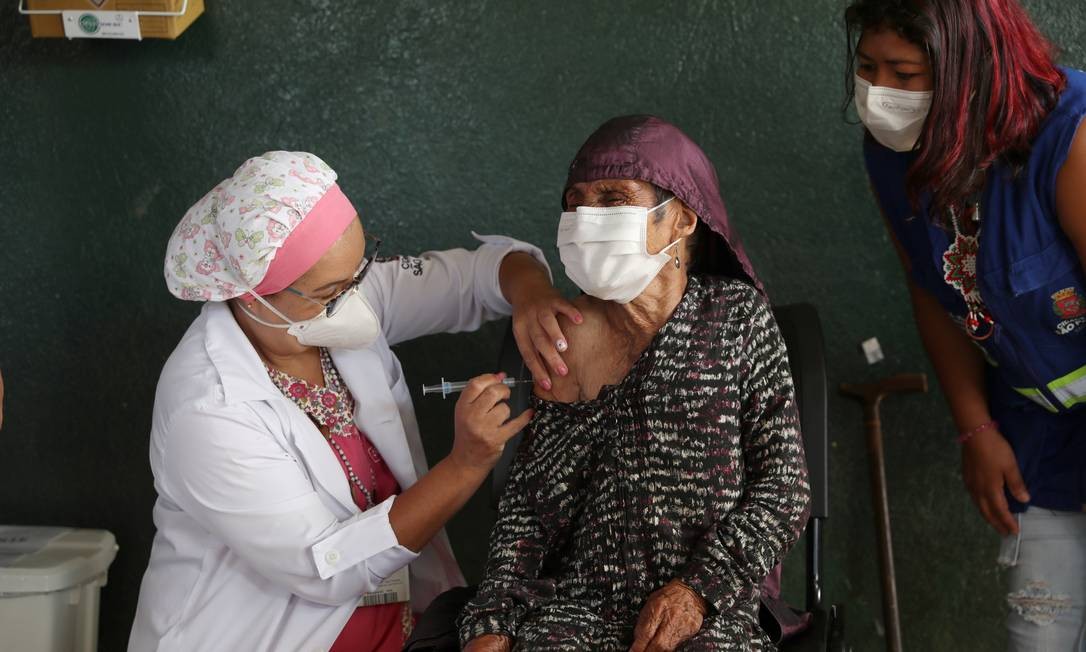
BRASÍLIA— A Pfizer enviou, neste sábado, pedido de registro definitivo de sua vacina contra a Covid-19 no Brasil à Agência Nacional de Vigilância Sanitária (Anvisa). Caso a agência dê o aval à empresa, o imunizante, que a farmacêutica desenvolve com a alemã BioNTech, poderá ser distribuído amplamente e comercializado no país.
O prazo estimado pela Anvisa para análise do processo de registro é de 60 dias. Atualmente, a Pfizer é um dos quatro laboratórios que desenvolvem estudos de fase 3 no Brasil. Os ensaios são desenvolvidos em São Paulo e Salvador com a participação de 2.900 voluntários.
Ministério da Saúde:‘Vacina da Pfizer causaria frustração em todos os brasileiros’
A farmacêutica tem sido alvo de críticas constantes por parte do Ministério da Saúde, que não avançou nas negociações para compra do imunizante. Em nota, a pasta afirmou que tem memorando de entendimento com a empresa e “aguarda envio, por parte da farmacêutica, das minutas de contrato e cronogramas de entrega das doses para dar seguimento às negociações.”
O memorando de entendimento com a Pfizer, que é um passo anterior à assinatura do contrato, prevê a aquisição de 70 milhões de doses da vacina, mas, até o momento, a negociação segue estacionada. Em janeiro, o Ministério da Saúde divulgou uma nota criticando a farmacêutica. Segundo a pasta, o laboratório impõe cláusulas ” leoninas e abusivas” para negociação da vacina.
Documentos, no entanto, mostraram que o governo contrariou parecer jurídico e excluiu de uma Medida Provisória editada em janeiro sobre a aquisição de vacinas um trecho que facilitava a compra de imunizantes do laboratório americano. O texto previa que o governo se responsabilizasse por eventuais eventos adversos causados pela vacina, uma das cláusulas pedidas pela Pfizer.
Vacina:Governo procura universidades para armazenar imunizante
Em nota, a Anvisa explicou que o processo de registro definitivo “é a avaliação completa com dados mais robustos dos estudos de qualidade, eficácia e segurança, bem como do plano de mitigação dos riscos e da adoção das medidas de monitoramento”.
Na quarta-feira, a Pfizer participou de uma reunião prévia de submissão com a Anvisa. Na semana passada a Fiocruz já havia solicitado o registro definitivo da vacina de Oxford/AstraZeneca no país. Os dados estão sendo analisados pela agência desde então.
“A Anvisa não impõe barreiras ou dificuldades para o pedido de registro de vacinas. Estabelece regras a serem cumpridas, a fim de garantir que as vacinas sejam seguras e adequadas para imunizar e não causar dano à população brasileira. Os servidores da agência estão dedicados à análise desses processos”, afirmou a Anvisa, em comunicado.
Natalia Pasternak:Estamos em uma corrida de vacinas versus vírus. Se bobearmos, o vírus ganha
Eficácia de 95%
Em nota, a Pfizer afirmou que a submissão contínua de documentos à Anvisa foi feita com base em dados de “segurança e eficácia avaliados de aproximadamente 44 mil participantes do estudo, que foram acompanhados por dois meses, em média, após a segunda dose da vacina experimental”.
Além do Brasil, a Pfizer conduziu testes nos Estados Unidos, na Alemanha, na Turquia, na África do Sul e na Argentina. A vacina contra a Covid-19 já teve aprovação emergencial em 40 países.
A empresa destacou no comunicado ainda os dados de eficácia do imunizante, que atingiu índice geral de 95% e de 94% em pessoas acima de 65 anos.
“O pedido de registro da vacina junto à Anvisa é a etapa final do processo de submissão continua estabelecido pela agência para acelerar os registros de vacinas contra a Covid-19. A companhia continuará trabalhando junto com a Anvisa para que esse processo transcorra da melhor maneira possível, sempre pautados por critérios técnicos e científicos”, disse Márjori Dulcine, diretora médica da Pfizer Brasil, no comunicado.